Fachübersetzungen im Bereich Biotechnologie
Biopharmazeutika und Biosimilars – die wachsenden Geschäftsfelder der Pharma- und Biotechnologieindustrie
Laut European Federation for Biotechnology versteht man unter Biotechnologie die integrierte Anwendung von Natur- und Ingenieurs-Wissenschaften, um Organismen, Zellen oder deren Komponenten für Produkte und Dienstleistungen nutzbar zu machen.
Die medizinische Biotechnologie (auch „rote Biotechnologie“ genannt) ist fokussiert auf die Entwicklung neuer therapeutischer und diagnostischer Verfahren. Mit ihren innovativen Wirkansätzen, Behandlungs- und Diagnosemethoden leisten Biopharmazeutika und Biosimilars wertvolle neue Beiträge zur lebensrettenden Behandlung verschiedenster Krankheitsbilder.
Fast jede zweite Pharma-Neuzulassung wird biotechnologisch hergestellt.
Übersetzungen im Bereich Biopharmazeutika
Fachgerechte Übersetzungen sind Voraussetzung dafür, dass auf internationaler Ebene sowohl die Studien durchgeführt als auch die aktuellen Erkenntnisse der Forschung und der technologischen Fortschritte ausgetauscht und erweitert werden können.
Eine besondere Herausforderung bei Biotech- und Pharma-Übersetzungen ist die Lokalisierung von Texten über nationale, sprachliche und kulturelle Grenzen hinweg.
Entwicklungs-, Studien- und Zulassungsdokumentation
Entsprechend den EU- und FDA-Vorgaben sowie den ICH-GCP-Standards erfordern die anspruchsvollen Zulassungsverfahren der Biopharmazeutika umfangreiche Untersuchungen in vielen Ländern und in vielen Sprachen.
Die mpü-Experten sind bestens gerüstet und erfahren zur Übersetzung aller Ihrer biopharmazeutischen Texte und Dokumente zu den Themen
- Eigenschaften (physikalisch, chemisch)
- Zusammensetzung (pharmazeutisch, biologisch)
- Wirksamkeit (PK, PD)
- Verträglichkeit (inkl. Immunogenität)
- Sicherheit
- Herstellung
- Zulassung
- Vertrieb, Marketing
- Risiko Management
- Post-Marketing Surveillance (Pharmakovigilanz)
mpü bietet spezifische Prozesse für neue Problemstellungen
International zugängliche Forschungsergebnisse
In der Biotechnologie werden Erkenntnisse aus den unterschiedlichsten wissenschaftlichen Bereichen wie Mikrobiologie, Biochemie, Medizin, Pharmazie oder Verfahrens-Technik genutzt. Um für unsere Kunden optimale Sprachlösungen zu erzielen, bringen die Fachübersetzer und Experten von mpü Expertise und Erfahrung in allen notwendigen Fachgebieten ein.
Dadurch können Ihre Entwicklungen neuer und effizienterer Verfahren in Anwendungsgebieten wie
- Medizinischer Diagnostik
- Pharmakogenomik
- Pränataler Diagnostik
- Gentherapie
- Regenerationsmedizin
- etc.
durch mpü in allen erforderlichen Sprachen global zugänglich gemacht werden.
Biosimilars
Biosimilars sind Nachfolgeprodukte von Biopharmazeutika, deren Patentschutz ausgelaufen ist. Ähnlich wie bei Generika besteht bei der Zulassung von Biosimilars die Möglichkeit, auf ein bereits zugelassenes Referenz-Arzneimittel Bezug zu nehmen.
Da jedoch bei biologischen Präparaten einfache Bioäquivalenznachweise nicht durchgeführt werden können, beruht die Zulassung von Biosimilars zu großen Teilen auf Vergleichbarkeitsstudien. Durch umfangreiche nicht-klinische und klinische Studien muss nachgewiesen werden, dass das Biosimilar dem Originalprodukt in Qualität, Wirksamkeit und Sicherheit sehr ähnlich ist.
Comparison of data requirements for approval of a biosimilar versus the reference medicine
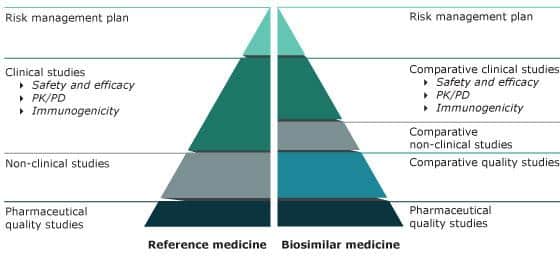
© Grafik: European Medicine Agency (EMA),
https://www.ema.europa.eu/en/human-regulatory/overview/biosimilar-medicines-overview, abgerufen 13JUN2022
Maßgeschneiderte Biotechnologie-Fachübersetzungen dank MPÜ-Expertise
Als Übersetzungsbüro und Sprachdienstleister sind wir auf den Biotech-, Medizin– und Pharma-Bereich spezialisiert. Das mpü-Team verfügt daher über die erforderlichen besonderen Kenntnisse, Erfahrungen und Voraussetzungen, die für Fachübersetzungen in diesen hoch spezialisierten Bereichen benötigt werden.
Ihre Vorteile auf einen Blick:
- Muttersprachliche Fachexperten als Übersetzer: mpü verfügt über ein weltweites Netzwerk von mehr als 3000 ausgewählten und geprüften Fachexperten aus Bereichen wie Biowissenschaften, Medizin, Pharma, Chemie, IT und Technik, Recht und Linguistik.
- Sprachkompetenz: Wir übersetzen in über 150 Sprachen, darunter alle EU-Sprachen wie Deutsch, Englisch, Spanisch, Französisch und Italienisch.
- Konsequentes Qualitätsmanagement: Unser mehrstufiger Qualitätssicherungs-Workflow basiert auf der international gültigen Qualitätsnorm DIN EN ISO 17100 und wird von uns durch zusätzliche interne Schritte erweitert.
- Moderne Technologien: Wo sinnvoll und nötig, setzen wir moderne Übersetzungs-Tools ein. Dazu zählen beispielsweise Übersetzungsdatenbanken (Translation Memory Systeme), die gleichermaßen Qualität und Effizienz erhöhen und zu einer besseren textübergreifenden Konsistenz beitragen.
- Umfassendes Leistungsangebot: mpü ist breit aufgestellt – wir übersetzen u.a. klinische Studien, Marketing-Materialien, technische Anleitungen, Verträge und andere juristische Dokumente, Produktinformationen etc. Darüber hinaus erstreckt sich unsere Expertise auf die Lokalisierung von Websites und Software-Anwendungen, beglaubigte Übersetzungen von Patenten, Audio- und Video-Dienstleistungen (inkl. Transkription), Lektorat und Korrektorat (Korrekturlesen), Dolmetschen und vieles mehr.









