Klinische Studien

Übersetzungen für klinische Prüfungen/Studien
Regulatorische Herausforderung und Patientensicherheit bei Übersetzungen für klinische Prüfungen
Sechs der Top Ten der Pharma-Branche vertrauen auf die mpü-Expertise bei Übersetzungen für klinische Prüfungen/klinische Studien.
Klinische Prüfungen werden zunehmend über nationale und sprachliche Grenzen hinweg in verschiedensten Ländern durchgeführt. Diese Internationalität und damit die Vielsprachigkeit der Studienteilnehmer sowie geographisch bedingte Besonderheiten sind für Unternehmen bei der Durchführung und der Auswertung klinischer Studien eine besonders große Herausforderung.
Wir stellen uns Ihren Herausforderungen und begleiten Sie durch alle Stadien Ihrer Arzneimittel-Forschung und -Entwicklung und Ihrer klinischen Prüfungen.

Besprechen Sie Ihr Projekt jetzt mit unseren Fachexperten. Wir beraten Sie gerne.
studies@mpue.com
+49 (0)731 954 950
Qualitätssicherung bei der Übersetzung von Dokumenten aus klinischen Prüfungen
mpü-Qualitätssicherung – kompetent und präzise
mpü hat langjährige Expertise in allen Stufen der klinischen Forschung, Arzneimittelentwicklung und -zulassung. Mit unserem erfahrenen Übersetzungs- und Sprachmanagement erfüllen wir alle Anforderungen an vielsprachige klinische Studien.
Entsprechend den Regularien und Empfehlungen der
- EMA-/FDA-*/ICH-GCP-Guidelines sowie der
- Behörden und Ethikkommissionen
liegt die Priorität der mpü-internen Qualitätssicherung darin, alle Dokumente und Unterlagen verlässlich und präzise für die jeweilige Zielgruppe und das Zielland in die Muttersprache der Studienteilnehmer zu übersetzen und verständlich zu lokalisieren.
Nur fehlerfreie Übersetzungen und eine kulturell und geographisch angepasste Lokalisierung von Texten gewährleisten Teilnahmebereitschaft der Patienten und Patientensicherheit.
* Food and Drug Administration Guidelines:
21 CFR 50.20 – General requirements for informed consent.
Fazit: Wenn eine Einwilligungserklärung in einer Sprache geschrieben ist, die der Patient nicht versteht, muss diese in eine Sprache übersetzt werden, die der Patient versteht.
Die mpü-Qualitätssicherung – der Weg zu einem Qualitätsprodukt
1
mpü ist nach DIN EN ISO 17100 zertifiziert und Ihre Fachübersetzungen werden entsprechend dem Prozess dieser international gültigen Qualitätsnorm durchgeführt.
Unser mehrstufiger Qualitätssicherungsworkflow basiert auf der DIN EN ISO 17100, wird jedoch von uns um zusätzliche mpü-spezifische Schritte erweitert, z. B. In-house Qualitätssicherung durch qualifizierte Linguisten.
2
Regionale und lokale Konventionen und Normen werden von den muttersprachlichen Übersetzern und Revisoren bei der Übersetzung und Lokalisierung von Texten berücksichtigt.
3
Rückübersetzung und Revision sowie Abgleich der Übersetzung für Dokumente aus klinischen Prüfungen, z. B. Patientenaufklärung, Einwilligungserklärung, QoL-, QuIC, PRO-Fragebögen.
Alle Validierungsschritte entsprechen den Anforderungen und Vorgaben der jeweiligen lokalen Ethikkommissionen/IRBs.
4
Erfahrenes Kompetenzteam aus Projekt- und Qualitätsmanagern begleitet Sie flexibel bei allen Schritten Ihres Projektes. Unsere zielorientierte Kundenkommunikation hält Sie stets auf dem Laufenden.
5
Qualifizierung der muttersprachlichen Fachübersetzer und Revisoren für klinische Prüfungen.
6
Fremdsprachen DTP und Fahnenkorrektur der gesetzten Dokumente durch muttersprachliche Lektoren.
7
Festlegung und Pflege von Terminologie
Ständige Steigerung der Qualität Ihrer Texte durch Terminologiemanagement.
Firmen- und abteilungsübergreifende Einhaltung der Fachterminologie und Corporate Language wird sichergestellt.
8
Translation Memory
Die Bearbeitung der Übersetzungsprojekte wird mit Translation-Memory-Systemen vorgenommen – Übersetzungstools, die im Workflow dazu beitragen: Kosten zu sparen, Durchlaufzeiten zu reduzieren, textübergreifende Konsistenz, formatierungsgetreue Bearbeitung, zu gewährleisten.

Qualität ist kein Zufall
mpü-Prozess –
Linguistische Validierung + kognitives Debriefing von PRO aus einer Hand
Da klinische Prüfungen/klinische Studien zunehmend auf internationaler Ebene durchgeführt werden, entsteht ein wachsender Bedarf an der Übersetzung, Harmonisierung und kulturellen Anpassung der Patient Reported Outcome Measures (PROM) und der Linguistischen Validierung der PROMs.
Linguistische Validierung: Übersetzungsschritte und Methoden im Überblick
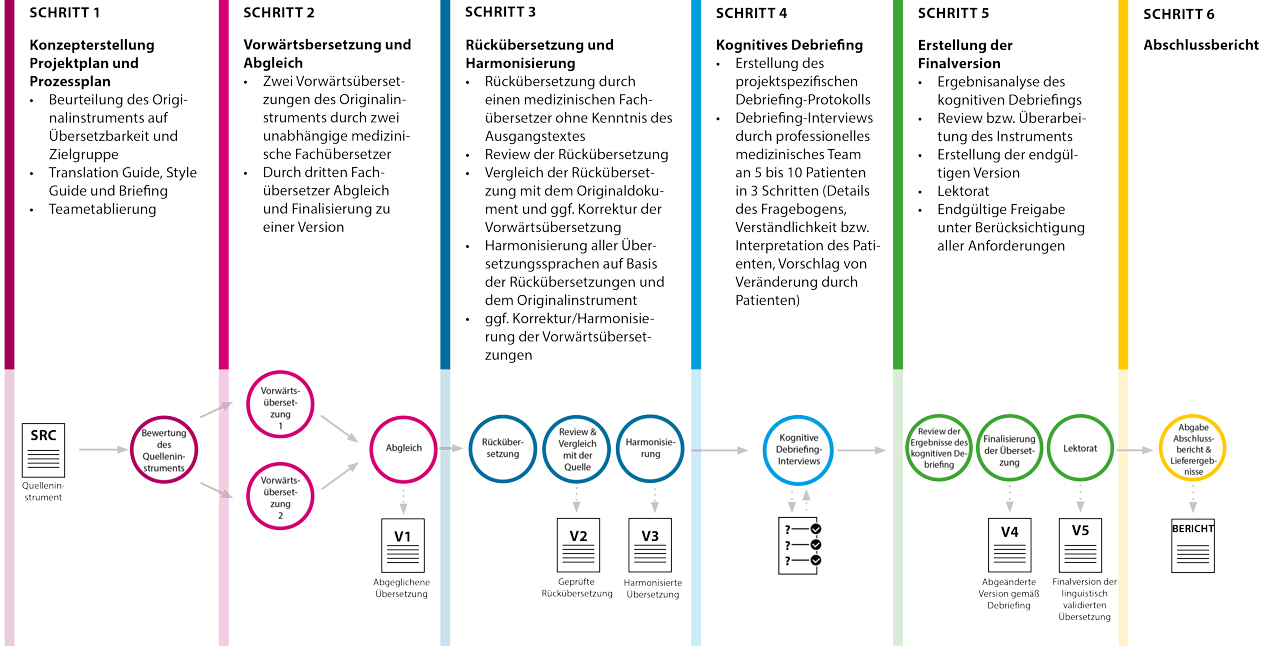
Für die Linguistische Validierung von PROMs hat sich folgender Workflow bewährt:
Prozess der linguistischen Validierung von PRO Instrumenten
SCHRITT 1: Konzepterstellung
- Projektplan und Prozessplan
- Beurteilung des Originalinstruments auf Übersetzbarkeit und Zielgruppe
- Translation Guide, Style Guide und Briefing
- Teametablierung
SCHRITT 2: Vorwärtsübersetzung und Abgleich
- Zwei Vorwärtsübersetzungen des Originalinstruments durch zwei unabhängige medizinische Fachübersetzer
- Abgleich und Finalisierung zu einer Version durch dritten Fachübersetzer
SCHRITT 3: Rückübersetzung und Harmonisierung
- Rückübersetzung durch einen medizinischen Fachübersetzer ohne Kenntnis des Ausgangstextes
- Review der Rückübersetzung
- Vergleich der Rückübersetzung mit dem Originaldokument und
ggf. Korrektur der Vorwärtsübersetzung
SCHRITT 4: Kognitives Debriefing
- Erstellung des projektspezifischen Debriefing-Protokolls
- Debriefing-Interviews durch professionelles medizinisches Team an 5 – 10 Patienten in 3 Schritten (Details des Fragebogens, Verständlichkeit bzw. Interpretation des Patienten, Vorschlag von Veränderung durch Patienten)
SCHRITT 5: Erstellung der Finalversion
- Ergebnisanalyse des kognitiven Debriefings
- Review bzw. Überarbeitung des Instruments
- Erstellung der endgültigen Version
- Lektorat durch Auftraggeber
- Endgültige Freigabe unter Berücksichtigung aller Anforderungen
SCHRITT 6: Abschlussbericht
Sie können für PROMs das komplette Paket der linguistischen Validierung einschließlich Rückübersetzung und kognitivem Debriefing oder auch nur einzelne Schritte auswählen.

Ist eine Linguistische Validierung für Ihre Studie erforderlich? Lassen Sie sich beraten.
studies@mpue.com
+49 (0)731 954 950
mpü – Ihr Experte für Linguistische Validierung mit kognitivem Debriefing von PROM
Übersetzungen + Patientenrekrutierung + Testung aus einer Hand
- Prozess VOR Beginn der Studie zur Sicherstellung, dass die Studienteilnehmer den Inhalt der Fragebögen richtig verstehen
- Übersetzungen ggf. mit Rückübersetzung mit Abgleich aller Fragebögen, die während der Studie von den Studienteilnehmern ausgefüllt werden müssen
- Übersetzungen und kulturelle Anpassung in alle Sprachen der Studienländer
- Rekrutierung der Patienten in allen Sprachen der Studienländer
- Durchführung des Tests (Cognitive Debriefing) in den Studienländern
- Patienten interpretieren und beurteilen dabei die in ihre Muttersprache übersetzten Studienfragebögen auf Verständlichkeit ohne Einflussnahme des Interviewers
- Entsprechend dem Ergebnis muss der Original-Text bzw. die Übersetzung einzelner Sprachen eventuell überarbeitet werden

Übersetzungen müssen überall verstanden werden.
mpü Expertise in Linguistischer Validierung mit kognitivem Debriefing
- mpü unterstützt Sie bei der Entwicklung von Strategien bereits ab den ersten Schritten der linguistischen Validierung einschließlich dem kognitiven Debriefing von PROMs in allen Zielsprachen.
- mpü liefert Ihnen verlässlich validierte PRO-Instrumente, die eine erfolgreiche Durchführung Ihrer globalen Studien ermöglichen.
- Die mpü-Prozesse garantieren Ihnen behördliche Akzeptanz und Compliance mit internationalen Standards.

Wir leben medizinische Übersetzungen
Linguistische Validierung: Unser Netzwerk – Ihr Erfolg
Das weltweite mpü-Netzwerk von
- medizinischen Übersetzern
- Fachexperten
- spezialisierten Ärzten
- In-Country-Reviewern und -Interviewern
- Linguistic Validators
bietet uns die Möglichkeit, sowohl die Rekrutierung der Patienten als auch das kognitive Debriefing im Zielland durchzuführen. Durch dieses mpü-Verfahren können wir unseren Kunden die wissenschaftliche Genauigkeit der PROMs gewährleisten.
Das kognitive Debriefing der übersetzten Dokumente ist ein ergebnisentscheidender Schritt. Wir stellen damit sicher, dass alle Patienten später in der Studie in allen Zielsprachen die PROMs richtig und überall gleich verstehen und ausfüllen können.
Jedes mpü-Projekt ist in allen Sprachen validiert und damit linguistisch äquivalent. Sie können sich darauf verlassen, dass Ihre Daten aus allen Ländern für die statistischen Analysen gepoolt werden können.
Qualitätsstandard für Prozesse der linguistischen Validierung und des kognitiven Debriefing von PRO
Das mpü-Know-how auf dem Gebiet der Übersetzung und Harmonisierung von papierbasierten oder elektronischen PRO-Instrumenten basiert auf unserer Fokussierung auf Übersetzungen von Dokumenten für weltweit agierende Pharmaunternehmen und CROs.
Die mpü-Prozesse und der Qualitätsstandard für die linguistische Validierung sowie das kognitive Debriefing von PROMs folgen allen wichtigen Guidelines:
- dem PRO Leitfaden der amerikanischen Food and Drug Administration (FDA)
- den Regularien der Europäischen Arzneimittel-Agentur (EMA)
- den ICH-GCP-Standards
- den Richtlinien der International Society for Pharmacoeconomics and Outcomes Research (ISPOR).
Sprechen Sie mit uns, gerne beraten wir Sie ausführlich und unterstützen Sie bei allen Arbeitsschritten und mit allen technischen Möglichkeiten, um den Ablauf Ihrer klinischen Prüfung effizient zu gestalten.
Übersetzungen für klinische Prüfungen in allen Stadien der Arzneimittelzulassung
mpü hat sich mit dem Ziel „100 % Qualität“ den höchsten Standards bei der Anpassung aller Prozesse an die einzelnen Dokumente verschrieben und wendet sie in jedem Stadium der Arzneimittel-Forschung und -Entwicklung an:
- Präklinik
- Klinische Phasen I – IV
- Anwendungsbeobachtungen
- Nichtinterventionelle Studien (NIS)
Mit unseren spezialisierten Übersetzungs- und Sprachlösungen, die den unterschiedlichsten Erfordernissen und Arbeitsbedingungen in der Pharma-Branche Rechnung tragen, unterstützen wir erfolgreich global agierenden Unternehmen und CROs.
Alle medizinischen Fachgebiete in 150 Sprachen
Das volle mpü-Leistungsspektrum kann in allen medizinischen Fachgebieten in Anspruch genommen werden, da unsere Sprach- und Fachexperten über große Erfahrung und Kompetenz in den jeweiligen medizinischen Disziplinen verfügen.
Dazu gehören unter anderem:
- Gynäkologie
- Geriatrie
mehr
- Kardiologie
- Zahnmedizin
- Neurologie
- Onkologie
- Orthopädie
- etc.

Zentralisieren Sie Ihre Übersetzungsstrategie und konzentrieren Sie alle Sprachen auf einen Sprachdienstleister.
studies@mpue.com
+49 (0)731 954 950
Unterschiedliche Dokumentenarten für
Patienten – Prüfärzte – Behörden
erfordern unterschiedliche Prozesse
Da die unterschiedlichen Dokumentenarten für verschiedene Zielgruppen bestimmt sind (Patienten, Prüfärzte, Behörden, Ethikkommissionen), erfordern das Übersetzen von Texten entsprechend der Zielgruppe und dem Dokumenteninhalt unterschiedliche Prozesse:
- Einwilligungserklärungen ICFs)
- Patienteninformationen (PISs)
- Prüfbögen (CRFs, eCRFs)
- Patiententagebücher & e-Tagebücher
- Korrespondenz mit Behörden und Ethikkommissionen
mehr
- Patientenkarten
- Patientenfragebögen
- Ergebnisse aus Patientenbefragungen (PRO)
- Untersuchungsbroschüren
- Synopsen von Prüfplänen
- Krankenakten
- AE/SAE/SUSAR – Berichte (Pharmakovigilanz)
- Prüfpläne
- Monitor- und Audit-Berichte
- Studienberichte
- Arztbriefe
- Prüfzentren – Dokumentation und Berichte
- Sicherheitsberichte
- Verpackung und Kennzeichnung des Prüfpräparats, Kennzeichnungsprüfung
- Patienteninformation, Packungsbeilage (PLs/PILs)
- Kommunikation mit Ethik-Kommissionen und Behörden
- Abschlussberichte (Clinical Trial Reports, CTRs)
- Zusammenfassung der Merkmale des Arzneimittels (SPC/SmPC)
- Zusammenfassungen für Laien
- Verträge
- Geheimhaltungsvereinbarungen
- Unterlagen zur Ausbildung von Personal der Prüfzentren
- Ein- und Ausfuhrgenehmigungen
Unser multilinguales DTP entsprechend Ihrem vorgegebenen Layout ergänzt unsere Leistungspalette.
Spezieller 24/48-Stunden-Service für Übersetzungen von
Adverse Event (AE), Serious Adverse Event (SAE) und Suspected Unexpected Serious Adverse Reaction (SUSAR) Reports
Um das zeitsensible Berichtswesen der AEs/SAEs/SUSARs umgehend (24/48 Stunden) erfüllen zu können, hat mpü einen speziellen Service eingerichtet.
Unsere bewährten und geprüften Prozesse sind darauf ausgerichtet, vielsprachige AE/SAE/SUSAR Reports zeitgerecht durchzuführen.
Durch die globale Aufstellung unseres Unternehmens und unserer Experten können wir die unterschiedlichen Zeitzonen nutzen, um diesem speziellen zeitkritischen Service gerecht zu werden.

Routiniert – zuverlässig – fachlich überzeugend
mpü ist ISO zertifiziert
mpü ist zertifiziert nach EN DIN ISO 9001 für einen reibungslosen Prozessablauf und eine zuverlässige Qualitätssicherung, sowie nach DIN EN ISO 17100, um die Qualität, die Ihre anspruchsvolle Dokumentation erfordert, sicherzustellen.
Zertifizierte Studiendokumente
mpü liefert zu jeder Übersetzungsoption ein Übersetzungszertifikat, in dem Angaben zu den beteiligten Linguisten und Fachexperten, eine genaue Beschreibung des gewählten Prozesses sowie Dokumententitel und Sprachrichtungen enthalten sind.
Außerdem können Beglaubigungen, Apostillen etc. auf Wunsch für jedes Dokument geliefert werden.
Nutzen Sie den mpü-Fremdsprachensatz für perfekte Dokumente
Vervollständigen Sie Ihre Studiendokumente mit unserer Kompetenz in multilingualem DTP.
- Wir passen die Übersetzung an,
- berücksichtigen die Sprachexpansion der unterschiedlichen Zielsprachen,
- unsere Muttersprachler überprüfen die gesetzten Dokumente und
- Sie erhalten Ihre Dokumente in Ihrem gewünschten finalen Format.
Länderspezifische Kennzeichnungsprüfung bei Übersetzungen von Labels/Etiketten Ihrer Prüfpräparate
Übersetzung und Validierung von Labels und Etiketten für Prüfpräparate (Studienarzneimittel) unter Berücksichtigung der Standard Terminologie
+
Kennzeichnungsprüfung der Labels und Etiketten für Prüfpräparate pro Land der Studienzentren
Optimaler Ressourceneinsatz für höchste Qualität
Bei Übersetzungen der Labels/Etiketten des Prüfpräparates im Rahmen von klinischen Studien ist der Aufwand für die eigentliche Übersetzung relativ gering. In jeder Sprache muss jedoch eine sogenannte Kennzeichnungsprüfung durchgeführt werden, die entsprechend den länderspezifischen Vorschriften/Regularien in jeder Sprache bzw. jedem Land unterschiedlich sein kann.
Durch das umfassende Know-how für alle Sprachprozesse rund um die Zulassungen und klinischen Studien hat sich mpü mit einem weiten Netz an Spezialisten für diesen speziellen Service aufgestellt.
Wir können auf Ihre spezifischen Anforderungen rasch reagieren und gestalten diese individuellen Workflows mit allen Schritten für Sie. Damit Ihre Studie zeitnah starten kann.
Kennzeichnungsprüfung im Rahmen von Übersetzungen für klinische Studien
Bei der länderspezifischen Kennzeichnungsprüfung des Prüfpräparates wird die Übersetzung des Masterlabels/-etiketts unter folgenden Kriterien geprüft und angepasst:
- genauer Inhalt des Masterlabels
- Zusammensetzung des Präparats
- zu untersuchende therapeutische Indikation
- zusammenfassende Synopse der klinischen Prüfung (welche die Art und die Anwendungsbedingungen des Präparats bestimmt)
- Sprache und Land der Studienzentren, um die Lokalisierung des Label-/Etiketteninhalts und damit die Einhaltung der im jeweiligen Land oder Gebiet geltenden juristischen Vorschriften zu gewährleisten.
Durch unsere spezialisierten Übersetzungs- und Sprachlösungen unterstützen wir global agierende Unternehmen und CROs erfolgreich bei allen Anforderungen der klinischen Prüfungen.
Warum mpü?
1
Unsere Flexibilität und Expertise ermöglicht allen global agierenden Unternehmen und CROs, unsere Kapazitäten als einen vollständigen Outsourcing Service oder als partiellen Dienstleister zu nutzen.
2
Kompetente Betreuung durch Ihren persönlichen Projektmanager.
3
150 Sprachen in allen Sprachkombinationen.
4
Kundenspezifische technische Lösungen und Workflow Design, um die klinischen Prozesse mit den Sprachprozessen zu kombinieren.
5
Schnelle Durchlaufzeiten durch optimierte Workflows und definierte Praktiken der Prozesskontrolle – präzise Ergebnisse.
6
Nahtlose Integration an die Anforderungen der CRO’s.
7
Unterstützung der CRO’s bei Ausschreibungen – Volumenrabatte und reduzierte Preise bei umfangreichen Übersetzungsprojekten und Ausschreibungen.
Lassen Sie keine Details bei Ihrer Studie verloren gehen – wir erstellen professionelle medizinische Übersetzungen.
FAQs
Was ist der Unterschied zwischen einer klinischen Prüfung und einer klinischen Studie?
Die Begriffe „klinische Prüfung“ und „klinische Studie“ werden im Deutschen häufig synonym verwendet. Die EU-Verordnung zu klinischen Prüfungen (EU) 536/2014 nimmt jedoch eine Unterscheidung vor:
- Eine klinische Studie ist „jede am Menschen durchgeführte Untersuchung […] mit dem Ziel, die Sicherheit und/oder Wirksamkeit von Arzneimitteln festzustellen“.
- Eine klinische Prüfung ist „eine klinische Studie, die mindestens eine der folgenden Bedingungen erfüllt:
a) Der Prüfungsteilnehmer wird vorab einer bestimmten Behandlungsstrategie zugewiesen, die nicht der normalen klinischen Praxis des betroffenen Mitgliedstaats entspricht;
b) die Entscheidung, die Prüfpräparate zu verschreiben, wird zusammen mit der Entscheidung getroffen, den Prüfungsteilnehmer in die klinische Studie aufzunehmen, oder
c) an den Prüfungsteilnehmern werden diagnostische oder Überwachungsverfahren angewendet, die über die normale klinische Praxis hinausgehen“.
Eine klinische Studie, die keine klinische Prüfung ist (also keine der drei Bedingungen erfüllt), ist nach dieser Definition eine nichtinterventionelle Studie.
[Quelle: https://eur-lex.europa.eu/legal-content/DE/TXT/?uri=CELEX%3A32014R0536]
Welche Rechtsgrundlagen sind bei klinischen Prüfungen auf EU-Ebene zu beachten?
Am 31.01.2022 ist die neue Verordnung (EU) 536/2014 (Englisch: Clinical Trial Regulation / CTR) in Kraft getreten. Diese Verordnung soll die klinische Forschung durch einheitliche juristische Anforderungen in der gesamten EU harmonisieren. Mit dem zentralen Informationssystem für klinische Prüfungen (Clinical Trials Information System / CTIS) wurde außerdem ein einheitliches Portal für Einreichungs- und Überwachungsverfahren geschaffen.
Können Fachübersetzungen für klinische Studien bzw. Prüfungen bei mpü auch kurzfristig in Auftrag gegeben werden?
Ja, durch unser flexibles und vorausschauendes Zeitmanagement garantieren wir Ihnen eine fristgerechte Lieferung zeitkritischer Dokumente. Für Übersetzungen von
Adverse Event (AE), Serious Adverse Event (SAE) und Suspected Unexpected Serious Adverse Reaction (SUSAR) Reports haben wir einen speziellen 24/48-Stunden-Service eingerichtet.
In welchen Sprachen sind Übersetzungen für klinische Studien bzw. Prüfungen möglich?
Unsere geprüften Fachexperten und Linguisten übersetzen in und aus mehr als 150 Sprachen. Neben gängigen Kombinationen wie Deutsch-Englisch zählen dazu auch Sprachen wie Russisch, Chinesisch oder Japanisch.
Kontaktieren Sie uns!
Wir freuen uns auf neue interessante Projekte.